干细胞是一类原始且未分化,具有自我更新,自动归巢,免疫原性低,多向分化潜能以及再生各种组织器官潜在功能的细胞,对多种难治性的人类重大疾病具有潜在治疗意义。多年来,各国对干细胞研究和临床转化非常重视,出台了一系列干细胞产品的相关指南,用于指导干细胞临床应用。2008年国际干细胞研究协会(ISSCR)制定了《干细胞临床转化指南》,2009年国际干细胞组织(ISCF)制定了《人胚胎干细胞建库和供应指南》,为干细胞临床转化研究奠定了基础。此后,美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)、世界卫生组织(WHO)、药品注册的国际协调组织(ICH)、ISSCR和ISCF等机构对干细胞从起始原材料到最终产品的质量控制、临床前和临床研究等进一步制定技术规范并更新了指南。截止到2024年10月23日,以“stem cell”作为关键词,搜索全球在clinicaltrials.gov注册的干细胞治疗临床试验方案有13 021项,统计有研究结果的项目1 942项,目前国际上已有20余种干细胞药物批准上市,干细胞治疗已成为各国研究的热点。
我国于2015年7月20日由原国家卫生和计划生育委员会和原国家食品药品监督管理总局联合发布了《干细胞临床研究管理办法(试行)》,同年7月31日,两部委又共同组织制定了《干细胞制剂质量控制及临床前研究指导原则(试行)》,以确保干细胞治疗的安全性和有效性。近年来,国家药品监督管理局药品审评中心出台了一系列相关指导原则,包括《细胞治疗产品研究与评价技术指导原则(试行)》 (2017.12),《人源干细胞产品药学研究与评价技术指导原则(试行)》 (2023.04),《人源干细胞产品非临床研究技术指导原则》 (2024.01)。截止到2024年12月底,我国共有159项干细胞药物向NMPA提交了IND申请,其中117项获临床默许,适应症包括:肺纤维化、膝骨关节炎、骨折、肝硬化、慢加急性肝衰竭、脑卒中、类风湿关节炎、糖尿病足溃疡、克罗恩病等。2025年1月2日,我国首款干细胞治疗药品-艾米迈托赛注射液(商品名:睿铂生)批准上市,标志着我国在干细胞治疗领域迈入了新阶段。
与其他药品相比较,干细胞具备自我更新和多向分化潜能,因此,干细胞产品的细胞类型多样,产品细胞本身具备体内生存、增殖、分化、细胞间相互作用等能力。干细胞产品作为一种活的无菌注射药物,生产过程中其干细胞来源、类型、扩增、基因修饰、诱导分化等存在较大差异,因此干细胞产品的均一性和稳定性相对较差,使用的时间窗口较短,其质量控制过程更加复杂,需要建立相应的快速有效的检验新方法新技术。为此申请并承担了北京市科委CGT课题研究任务“基因修饰免疫细胞和基因治疗药物质量控制关键技术与服务平台建设”部分项目,建立了相应的包括干细胞产品检验检测的新方法,为企业申报干细胞产品临床研究或新药审批进行检验奠定了基础。
为迎接即将到来的干细胞产品的研究热潮,我们组织干细胞产品质量分析专业人员撰写相关论文数篇,特设3期“干细胞产品质量研究与检测专栏”,内容涉及干细胞产品质量控制检测新技术新方法以及干细胞检测实验室质量体系的构建。本期4篇文章,包括“干细胞产品质量控制分析方法研究进展” “间充质干细胞产品生物学活性检验方法建立” “间充质干细胞端粒酶催化亚基RT-qPCR方法的建立” “AAV载体-HPV16-HPV18-HPyV假病毒的构建及其在干细胞人源病毒检查中的应用”。希望借助专栏的内容,为相关企业及研究机构提供参考,促进干细胞产品的临床研究和产业化进程。

紫草为少数民族聚集地常用药材,同时也是常用大宗中药材,目前国内中药材市场上对其年需求量约为1 200吨,但新疆紫草的年产量尚不足100吨。紫草的功能为清热凉血、活血解毒、透疹消斑,可用于血热毒盛、斑疹紫黑、麻疹不透、疮疡、湿疹、水火烫伤。现有可查含紫草的中成药处方122条,中药方剂195条,说明紫草应用广泛且具有重要的药效价值。市场上常见的紫草除药典规定的内蒙紫草和新疆紫草2个品种外,在河北、辽宁和江西等地常用硬紫草,在云南等地常用滇紫草和露蕊滇紫草,在四川等地常用密花滇紫草,在广西和广东等地常用蔷薇科的委陵菜(俗称北紫草)。多地区习用药材与药典收载基原药材不一致,由于药典品种受资源限制,市场供不应求,同时又有进口资源(具体来源尚不明确)混淆于市场中,导致紫草应用的混乱。目前药典收载基原之一的新疆紫草已有人工栽培,但栽培新疆紫草与野生来源新疆紫草的一致性有待考察。因此,扩大紫草药材的资源,填补市场需求的空缺,是一项十分重要与迫切的任务。
2015年,中国食品药品检定研究院中药民族药检定所开展了紫草的全国抽检工作,结论为新疆紫草资源匮乏,内蒙紫草濒临枯竭,目前市场上不合格紫草饮片的占有率较高。故中药民族药检定所启动紫草类药材的专项研究,协助抚育新疆紫草,现已在新疆多地栽培成功并不断扩大栽培面积,以期解决紫草的资源匮乏问题。2022年,中药民族药检定所再次启动紫草的国家药品抽检工作,结果显示紫草饮片的合格率由2015年的43.9%提高到87.5%,合格率大幅度提升。
为深入开展紫草类民族药的质量标准研究,本刊特设“紫草类民族药材的品质评价研究专栏”,“基于2015年和2022年国家药品抽检探讨紫草的质量现状”全面分析了2次紫草抽检工作反映的问题,通过2次抽检工作的研究发现,完善紫草药典标准,建立科学的检验项目,加强质控体系的建设对紫草监管有重要意义;“基于DNA条形码和PCR-RFLP技术的进口紫草ITS2序列特征研究”为市场紫草药材和饮片的质量控制与真伪鉴别提供参考依据;“基于巢式PCR的紫草鉴别引物筛选”可用于高效扩增与鉴别紫草市场样品真伪的特异性引物,为后续紫草类民族药材的鉴定方法研究与开发提供可参考的依据;“基于‘辨色论质’的新疆紫草质量评价研究“对比了新疆紫草的色泽与6个主要紫色素成分含量的相关性,通过药材颜色对紫草的质量进行评价;“紫草市场药材正伪品对小鼠肠道菌群调节作用的比较研究”基于宏基因组测序的方法,比较了紫草市场药材正伪品对小鼠肠道菌群调节作用的异同;“新疆紫草野生品与栽培品的质量比较研究”通过性状对比和化学计量学,对比新疆紫草野生品与3个不同地区栽培品的差异性成分,从而对新疆紫草野生品与栽培品的质量进行比较研究,确立最佳的紫草栽培基地。
希望通过本研究专栏,提供紫草研究的新思路、新方法,在此基础上拓展紫草研究的深度和广度,从而促进紫草类民族药的创新发展。
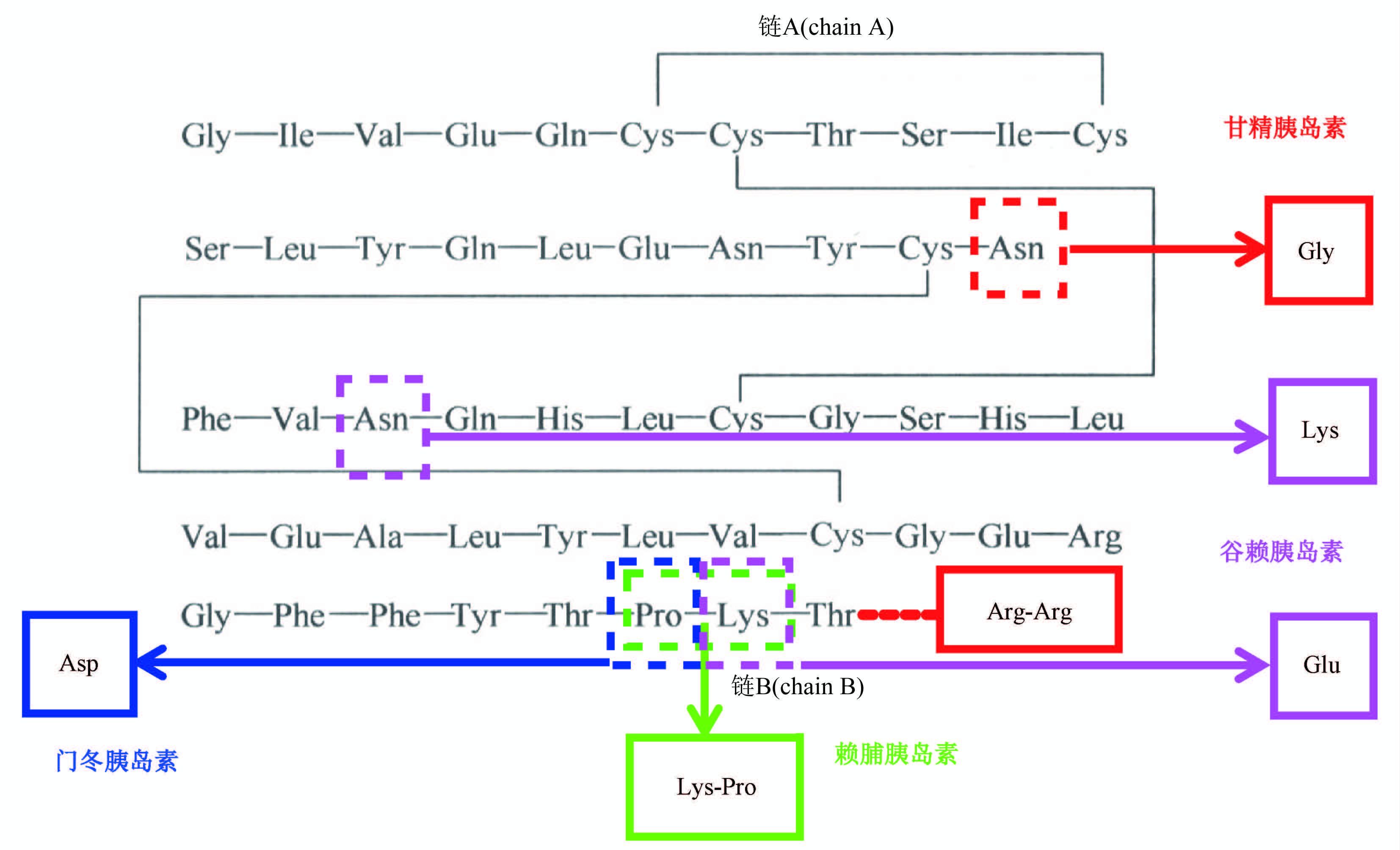
重组激素类药物是最早用于临床治疗的生物技术药物,是目前全球销售额仅次于单抗的第二大类治疗性蛋白药物。在临床上对诸如糖尿病、生殖类疾病、骨质疏松症等重大慢性病、退行性疾病的治疗具有不可替代的作用,对于国家医保、公众大健康等民生工程具有重大意义。由于重组激素类药物设计基础主要来自于人和动物体内天然存在的蛋白和多肽活性分子,经过100多年的研究,人类对其分子类别、药理和药效的认知十分完善,基于新靶点、新分子实体的源头创新药物开发现阶段难度很大。国际上的研发热点主要集中在有重大临床价值的长效化,蛋白质工程改构,复方制剂产品,诸如甘精胰岛素、赖脯胰岛素、德谷胰岛素、利拉鲁肽、度拉鲁肽等“重磅炸弹”级的生物药。我国人口基数大、老龄化问题日渐凸显,临床上对于重组激素类药物的需求仍处于快速增长阶段。上市产品个数、生产企业数量,近几年有显著增加,某些当前仍依赖进口的临床亟需品种也陆续进入上市申报阶段。
伴随着生物技术产业的发展,在国家药品监管部门的持续支持下,中国食品药品检定研究院在重组激素类药物质控分析方法、质量标准研究等方面积累了丰富的经验,使得《中华人民共和国药典》(以下简称《中国药典》)收载的各论标准持续保持国际水平。此外,中国食品药品检定研究院在聚乙二醇修饰重组激素药物方面开展的多项创新性研究,最终使2020年版《中国药典》三部中收录了国际首个人用聚乙二醇重组蛋白及多肽制品总论。由于发展需求,从2020年版开始,重组激素类药物转入《中国药典》三部收录。为此,中国食品药品检定研究院承担了国家药典委员会的系列标准提高课题,完成了人胰岛素及其制剂、甘精胰岛素及其制剂、赖脯胰岛素及其制剂、注射用人生长激素等10个各论的起草或修订。
本期“重组激素类药物质量分析专栏”,特邀相关专业人员撰写论文10篇,内容涉及重组激素药物国家标准研究的策略和技术要点考量,标准提高过程中开展的针对性研究,体外活性替代方法的探索性研究,以及国家标准物质的研制等。旨在为我国重组激素类药物国家标准更好地满足服务监管,促进行业发展,以及国际互认的战略需求提供参考。同时,希望本专栏能够为重组激素类药物开发过程中的质量设计和研发决策提供一些可借鉴的思路,助力我国上市产品提升全球价值。
基因治疗(gene therapy)是指将核酸片段以适当的方式导入细胞,使核酸的遗传信息发挥相应功能治疗疾病的方法。基因治疗制品是实现这一方法的工具。
自20世纪90年代以来,基因治疗迅猛发展,本世纪国内外多款基因治疗制品获批上市,其中重组腺相关病毒(rAAV)载体的基因治疗制品全球已有7款品种获批上市,国内近3年,有26款rAAV制品获批临床试验许可,适应症包括眼科疾病、血液系统疾病、神经系统疾病及感染性疾病等,血清型涉及达2型、5型、8型、9型和10型等。
随着越来越多的基因治疗产品进入临床,也逐渐暴露出产品潜在的安全风险,因此,各国监管部门也都在加速制定相关法规和技术指南,用于指导基因治疗制品的研发和评价。2020年版《中华人民共和国药典》三部“人用基因治疗制品总论”和国家药品监督管理局药品审评中心(CDE)发布的针对rAAV基因治疗制品的相关指导原则,对质量控制提出了原则性要求,但鉴于rAAV是某种“活”病毒形式,其生产和质量控制还需要更高要求,目前的检测方法还需要持续完善,方法的耐用性和结果的重复性也需要提高。因此,为了推进新理念、新技术、新工具和新标准尽早应用于基因治疗制品质量控制,特设立“基因治疗制品质量评价技术与方法专栏”,以展示质量分析技术的研究进展。专栏共9篇文章分2期刊出, 2023年11期已发表5篇文章。本期专栏继续刊出4篇文章,主要内容包括:1.多重数字PCR在rAAV基因组完整性评价中的探索应用,探讨了rAAV制品完整基因组定量方法;2.数字PCR技术检测rAAV产品中质粒DNA残留,探讨了质粒DNA拷贝数表征残留的方法;3. qPCR法用于rAAV2-ND4注射液中可复制型AAV的检测,探讨了一种2轮培养和qPCR检测rcAAV的方法;4.不同血清型腺相关病毒衣壳蛋白氨基酸残基序列分析,探讨了rAAV制品血清改变的原理。
希望借助本专栏,引发产业界和研究机构对rAAV制品质量的关注,不断提升从业人员在rAAV制品质量控制上的认识,提高检验检测能力,同时探讨和建立相应的实验方案,推动质量控制疑难问题的解决,进而促进我国rAAV基因治疗制品质量控制体系建设和技术规范完善,加速推动基因治疗制品高质量的发展。
基因治疗(gene therapy)是指将核酸片段以适当的方式导入细胞,使核酸的遗传信息发挥相应功能,达到治疗疾病的目的。自20世纪90年代以来,基因治疗迅猛发展,本世纪国内外多款基因治疗制品获批上市,其中重组腺相关病毒(rAAV)载体的基因治疗制品全球已有7款品种获批上市,国内近3年,有26款rAAV制品获批临床试验许可,适应症包括眼科疾病、血液系统疾病、神经系统疾病及感染性疾病等,血清型涉及达2、5、8、9和10型等。
随着越来越多的基因治疗产品进入临床,也逐渐暴露出产品潜在的安全风险,因此,各国监管部门也都在加速制定相关法规和技术指南,用于指导基因治疗制品的研发和评价。2020年版《中华人民共和国药典》三部“人用基因治疗制品总论”和国家药品监督管理局药品审评中心(CDE)发布的针对rAAV基因治疗制品的相关指导原则,对基因治疗制品的质量控制提出了原则性要求,但由于rAAV是“活”的病毒,其生产和质量控制需要更高要求,目前的检测方法还需要持续完善,方法的耐用性和结果的重复性也需要提高。因此,为了推进新理念、新技术、新工具和新标准尽早应用于基因治疗制品质量控制,特设立“基因治疗制品质量评价技术与方法专栏”,展示质量分析技术的相关研究进展,专栏包括9篇文章,因篇幅限制,分2期刊出。本期的题目和侧重内容包括①“重组腺相关病毒(rAAV)基因治疗制品质控检验技术重点考量”,介绍rAAV制品专属检测项目设置和方法特异考察点等;②“rAAV2-ND4注射液基因转录水平的生物学活性检测方法”,重点介绍1种内参基因和参比品双重校正的生物学活性检测方法;③“rAAV5基因组滴度测定的数字PCR方法研究”,侧重介绍微滴和芯片数字PCR的比较;④“CGE-LIF方法分析重组腺相关病毒(rAAV)衣壳蛋白的比例含量”,描述通过CE-LIF技术相对定量衣壳蛋白亚单位的检测方法;⑤“应用SEC-UV -MALS-RI技术分析重组腺相关病毒(rAAV)的颗粒滴度和实心率”,分享SEC-MALS联用技术在rAAV制品质量控制层面的应用。
希望借助本专栏,引起产业界和研究机构对rAAV制品质量的关注,不断提升从业人员在rAAV制品质量控制上的认识,提高检验检测能力,同时探讨和建立相应的实验方案,推动质量控制疑难问题的解决,进而促进我国rAAV基因治疗制品质量控制体系建设和技术规范的完善,加速推动基因治疗制品高质量的发展。

生物活性检测方法(bioassay或biological method)是评价生物制品等药品质量的重要组成部分。生物活性检测方法的验证(bioassay validation)是确保生物活性检测结果准确可靠,保障生物制品质量科学、可靠的重要方式;是质量保证体系关键控制点之一,也是GMP、实验室认证等各种认证认可的重点审核内容。
生物活性检测方法起始于20世纪初期,因其影响因素多,操作复杂,结果变异性大等特点,在20世纪,生物和统计2个领域的科学家主要围绕其应用进行研究(即国内熟知的“生物检定”)。自2010年后,由于分析质量源于设计(analytical quality by design, AQbD)、生命周期、风险评估和六西格玛等理念的发展和渗透,全球药品领域方法论研究者重新审视生物活性检测方法和理化方法的验证,将研究重心转移到检测方法全生命周期的前段内容,即方法设计、研发和验证等。由此开启生物活性检测方法的系统方法学研究。具体可参见本专栏的“生物活性检测方法的方法学研究概述”。
本期专栏收载的10篇论文是在国家重大专项课题、药典课题和中国食品药品检定研究院质量安全与能力建设项目的资助下,用时6年多的研究成果。2019年,本课题组已在本刊第2期中,就理化方法的部分方法学研究内容做了阶段性成果的专栏报道。本期刊载的内容是在广泛借鉴国际生物活性检测方法研究成果的基础上,对其进行的系统化研究和创新应用。
专栏中,“生物活性检测方法的方法学研究概述”梳理了生物活性检测方法的历史发展进程、国内外法规现状及最新研究进展。“生物活性检测方法定义及分类辨析”主要借助术语学理论探索了生物活性检测方法的定义和系统分类,并对国内关于该方法的几个表达名称进行了辨析,以帮助读者从全局角度科学的认识生物活性检测方法的本质。“生物活性检测方法研究中常用关键术语辨析”则对描述生物活性检测方法中最常用且易混淆术语进行了比较和释义。“生物活性检测方法量效关系模型的确立问题探讨”则重点探讨了生物活性检测方法验证中亟需量-效模型确立和评估问题。“生物效价报告值表示的科学规范性探讨”和“生物效价限度标准的确立要点探讨”2篇文章则针对生物效价表达及其在质量标准制定中存在的不足,系统阐述生物效价在制定其质量限度标准、检验报告中应呈现内容(包括方法适用性信息、报告值的限度标准、报告值的有效数字)和计算等相关原理。“生物活性检测方法的验证实验设计探讨”从风险分析和统计设计角度围绕如何获得科学可靠的方法性能参数进行了阐述,提供了方法验证的常用实验设计和思考模式。“方法满足预期用途的评估方式和标准探讨”系统阐述了描述方法能力的参数,包括报告值的容忍区间、预测区间、方法能力指数和方法误判率。“方法验证数据集的应用探讨”则主要总结了方法通过验证后,利用其数据集可以衍生出的一些有价值的应用特性指标,包括方法的操作模式变异度、报告值区分阈值、实验室能力标准差和影响方法的重要因素分析。最后,“生物活性检测方法验证统计分析软件的设计和功能”介绍了本实验室自主研发的专用于生物活性检测方法验证的统计软件(BMV1.0),可很好地帮助实验人员解决验证中需提供的各方法特性指标统计分析难题。
希望本专栏的相关内容能为药品监管部门、检验机构和生产企业的相关人员,在生物活性检测方法评估方面,提供系统全面的理论依据和统计分析支撑。
民族药是中国传统医药的重要组成部分,已经形成了自己独特的医药理论体系,各民族在几千年相互融合的过程中形成了“多元一体、合而不同”的发展现状。我国少数民族人口占全国总人口的6%,但其聚居地占全国总面积的60%。我国民族药材多达8 000余种,占我国药材资源总数的70%以上,分属于40多个不同民族的文化体系,具有生物多样性与文化多样性。民族药成药品种已有600多种,其中有47种在2000年被国家劳动和社会保障部门列入国家基本医疗保险用药目录。
中国食品药品检定研究院(以下简称中检院)于 2012年6月在中检院中药民族药检定所设立民族药室,从国家层面开展民族药质量检验与研究工作,探索适合民族药质量控制发展的新模式,提升民族药质量检验工作水平,体现了对民族药质量研究工作的高度重视,对民族药检验工作的发展具有里程碑的意义。2013—2014年,中检院策划组织了民族药调研项目,并得到国家药品监督管理局(以下简称国家局)药品注册管理司的专项资金支持。自2015年起,中检院作为牵头单位,联合13个民族省(区)药检院(所)共同开展研究工作。在国家局的支持下,现已开展3期项目研究,已完成25种特色民族药材质量标准草案,研究成果形成了100余万字的结题报告汇编。自2021年6月起,本项目增加了5个实力较强的省级药检单位开展合作研究,并开展32个民族药品种的研究工作。
为了加强民族药的研究,本刊特设“民族药研究专栏”,包括1篇综述和7篇论著,《基于1994—2021年专利分析民族药的发展及思考》从专利角度对1994—2021年我国民族药的发展现状进行分析,结果显示我国民族药专利申请经历了1994—2003年的萌芽阶段,2003—2018年的快速发展阶段,2019年至今的稳步发展阶段,反映了在国家对民族药的重视和支持下,民族药工作已取得了一定的成就;《固相萃取结合薄层色谱法鉴别滋肾育胎丸中的何首乌、续断、巴戟天和白术》对《中华人民共和国卫生部药品标准》收载的包括15味药材的复方滋肾育胎丸进行标准提升研究,为后续开展民族药复方研究奠定基础;《基质辅助激光解吸质谱成像可视化分析巴戟天炮制品中化学成分的空间分布》采用MALDI-MSI 技术获得南药巴戟天中化学成分的空间分布信息,结合UPLC技术测定含量,为进一步完善巴戟天的质量提供支撑,也为民族药研究提供一种新的思路;《广西民族药材小叶金花草质量标准提升研究》完善了广西民族药材小叶金花草质量标准,提高其质量控制水平;《藏成药石榴健胃散基因组DNA提取方法的比较及优化》《基于特异性引物的藏成药石榴健胃散HRM鉴别方法研究》《基于响应面法优化紫草药材的基因组DNA提取条件》和《基于DNA条形码和HRM技术建立紫草药材的RFLP-HRM鉴别方法》采用DNA鉴定技术对紫草和石榴健胃散的基因组DNA的提取进行优化,为民族药的正本清源提供数据支撑。
希望通过本研究专栏,为读者提供民族药研究的新思路、新方法,在此基础上拓展民族药研究的深度和广度,从而促进民族药创新发展,探索合适的民族药研究新模式,共同推动民族药领域基础研究的发展。